Đừng bỏ lỡ những tính năng hấp dẫn của Baitap365.com
Chương 6. Tốc độ phản ứng hóa học
Ôn tập chương 6 trang 73, 74 SBT Hóa 10 Chân trời sáng tạo
Bài 17. Tính chất vật lí và hóa học các đơn chất nhóm VIIA trang 75, 76, 77 SBT Hóa 10 Chân trời sáng tạo Bài 16. Các yếu tố ảnh hường đến tốc độ phản ứng hóa học trang 67, 68, 69 SBT Hóa 10 Chân trời sáng tạo Bài 15. Phương trình tốc độ phản ứng và hằng số tốc độ phản ứng trang 63, 64, 65 SBT Hóa 10 Chân trời sáng tạoÔn tập chương 6 trang 73, 74 SBT Hóa 10 Chân trời sáng tạo
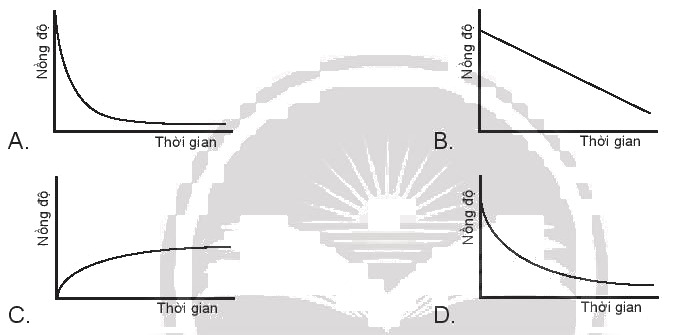
Phản ứng 2NO(g) + O2(g) → 2NO2(g) có biểu thức tốc độ tức thời: v= (k.C_{NO}^2.{C_{{O_2}}}). Nếu nồng độ của NO giảm 2 lần, giữ nguyên nồng độ oxygen, thì tốc độ sẽ A. giảm 2 lần. B. giảm 4 lần. C. giảm 3 lần. D. giữ nguyên. Nếu mỗi đồ thị có các chất phản ứng cùng nồng độ và trục thời gian thì tốc độ của chất phản ứng nào xảy ra nhanh nhất?
6.1
Phản ứng 2NO(g) + O2(g) → 2NO2(g) có biểu thức tốc độ tức thời: v= k.C2NO.CO2. Nếu nồng độ của NO giảm 2 lần, giữ nguyên nồng độ oxygen, thì tốc độ sẽ
A. giảm 2 lần.
B. giảm 4 lần.
C. giảm 3 lần.
D. giữ nguyên.
6.2
Nếu mỗi đồ thị có các chất phản ứng cùng nồng độ và trục thời gian thì tốc độ của chất phản ứng nào xảy ra nhanh nhất?
6.3
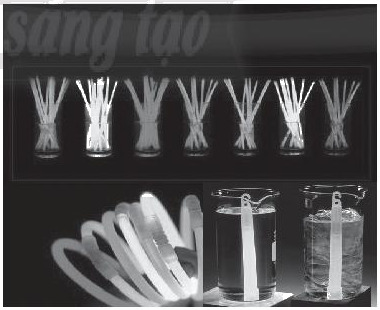
Thanh phát sáng là một sản phẩm quen thuộc được dùng giải trí. Đặt 2 thanh phát quang hóa học vào 2 cốc nước nóng (trái) và lạnh (phải) như hình bên, yếu tố ảnh hưởng đến độ phát sáng của 2 thanh là
A. nồng độ.
B. chất xúc tác.
C. bề mặt tiếp xúc.
D. nhiệt độ.
6.4
Trong hầu hết các phản ứng hoá học, tốc độ phản ứng tăng khi nhiệt độ tăng. Muốn pha một cốc trà đá có đường, bằng cách thêm đá viên và đường vào cốc trà nóng, thứ tự nào sẽ được cho vào trước?
6.5
Cho phương trình hoá học của phản ứng: 2CO(g) + O2(g) → 2CO2(g). Với biểu thức tốc độ tức thời là v=k.C2CO.CO2, khi nồng độ mol của CO là 1 M và O2 là 1 M, tính giá trị v và nêu ý nghĩa của k.
6.6
Từ thí nghiệm ảnh hưởng của bề mặt tiếp xúc đến tốc độ phản ứng trong SGK trang 101, 102, nếu ở bình (2), sau thời gian 60 giây, thể tích khí CO2 thu được là 30 mL. Tính tốc độ trung bình (mL/s) của phản ứng trong 60 giây.
6.7
Trong phản ứng. A → sản phẩm
Tại thời điểm t = 0, nồng độ chất A là 0,1563 M, sau 1 phút, nồng độ chất A là 0,1496 M và sau 2 phút, nồng độ chất A là 0,1431 M.
a) Tính tốc độ trung bình của phản ứng trong phút thứ nhất và trong phút thứ 2.
b) Nhận xét tốc độ phản ứng trong phút thứ nhất và phút thứ 2. Giải thích.
6.8
Xét phản ứng phân huỷ N2O5 theo phương trình hoá học:
2N2O5(g) → 4NO2(g) + O2(g), xảy ra ở 56°C cho kết quả theo bảng:
|
Thời gian (s) |
N2O5(M) |
NO2(M) |
O2(M) |
|
240 |
0,0388 |
0,0315 |
0,0079 |
|
600 |
0,0196 |
0,0699 |
0,0175 |
Tính tốc độ trung bình của phản ứng trong khoảng thời gian trên.
6.9
Sự phân huỷ H2O2, theo phương trình hoá học: 2H2O2(aq) → 2H2O(l) + O2(g), được nghiên cứu và cho kết quả tại một nhiệt độ cụ thể như sau:
|
Thời gian (s) |
H2O2 (mol/L) |
|
0 |
1,000 |
|
120 |
0,910 |
|
300 |
0,780 |
|
600 |
0,590 |
|
1200 |
0,370 |
|
1800 |
0,220 |
|
2400 |
0,130 |
|
3000 |
0,082 |
|
3600 |
0,050 |
a) Tính tốc độ trung bình của phản ứng phân huỷ H2O2 theo thời gian.
b) Tốc độ phản ứng thay đổi thế nào theo thời gian? Giải thích sự thay đổi đó.
Mẹo tìm đáp án nhanh
Search Google: "từ khóa + baitap365" Ví dụ: "Bài 5 trang 13 SGK Vật lí 12 baitap365