Đừng bỏ lỡ những tính năng hấp dẫn của Baitap365.com
Chương 3. Liên kết hóa học
Bài 10. Liên kết cộng hóa trị trang 34, 35, 36 SBT Hóa 10 Chân trời sáng tạo
Bài 11. Liên kết Hydrogen và tương tác van der Waals trang 39, 40, 41 SBT Hóa 10 Chân trời sáng tạo Ôn tập chương 3 trang 42, 43 SBT Hóa 10 Chân trời sáng tạo Bài 9. Liên kết ion trang 30, 31, 32 SBT Hóa 10 Chân trời sáng tạo Bài 8. Quy tắc Octet trang 28, 29 SBT Hóa 10 Chân trời sáng tạoBài 10. Liên kết cộng hóa trị trang 34, 35, 36 SBT Hóa 10 Chân trời sáng tạo
Trong phân tử ammonia (NH3), số cặp electron chung giữa nguyên tử nitrogen và các nguyên tử hydrogen là Biết nguyên tử chlorine có 7 electron hoá trị, công thức electron của phân tử chlorine là
10.1
Trong phân tử ammonia (NH3), số cặp electron chung giữa nguyên tử nitrogen và các nguyên tử hydrogen là
A. 3.
B. 2.
C. 1.
D. 4.
10.2
Biết nguyên tử chlorine có 7 electron hoá trị, công thức electron của phân tử chlorine là
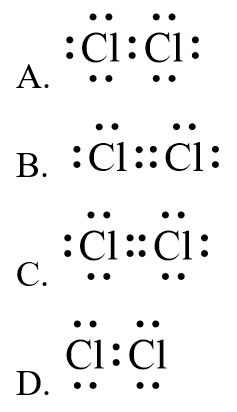
10.3
Chất nào sau đây không có liên kết cộng hoá trị phân cực?
A. O2.
B. CO2.
C. NH3.
D. HCl.
10.4
Chất vừa có liên kết cộng hoá trị phân cực, vừa có liên kết cộng hoá trị không phân cực là
A. CO2.
B. H2O.
C. NH3.
D. C2F6.
10.5
|
Nguyên tố |
Độ âm điện |
Nguyên tố |
Độ âm điện |
|
Na |
0,93 |
O |
3,44 |
|
H |
2,20 |
Br |
2,96 |
|
C |
2,55 |
Cl |
3,16 |
|
N |
3,04 |
F |
3,98 |
Liên kết nào dưới đây là liên kết cộng hoá trị không phân cực?
A. Na-O.
B. O-H.
C. Na-C.
D. C-H.
10.6
|
Nguyên tố |
Độ âm điện |
Nguyên tố |
Độ âm điện |
|
Na |
0,93 |
O |
3,44 |
|
H |
2,20 |
Br |
2,96 |
|
C |
2,55 |
Cl |
3,16 |
|
N |
3,04 |
F |
3,98 |
Lực kéo electron về phía nguyên tử nitrogen mạnh nhất ở liên kết nào dưới đây?
A. N-H.
B. N-F.
C. N-Cl.
D. N-Br.
10.7
|
Nguyên tố |
Độ âm điện |
Nguyên tố |
Độ âm điện |
|
Na |
0,93 |
O |
3,44 |
|
H |
2,20 |
Br |
2,96 |
|
C |
2,55 |
Cl |
3,16 |
|
N |
3,04 |
F |
3,98 |
Liên kết nào trong các liên kết sau là phân cực nhất?
A. C-H.
B. C-F.
C. C-Cl.
D. C-Br.
10.8
Hợp chất nào sau đây chứa cả liên kết cộng hoá trị và liên kết ion?
A. CH2O.
B. CH4.
C. Na2O.
D. KOH.
10.9
Các liên kết trong phân tử nitrogen được tạo thành do sự xen phủ của
A. các orbital s với nhau.
B. 2 orbital s và 1 orbital p với nhau.
C. 1 orbital s và 2 orbital p với nhau.
D. 3 orbital p giống nhau về hình dạng và kích thước, chỉ khác nhau về sự định hướng trong không gian.
10.10
Điều nào sau đây sai khi nói về tính chất của hợp chất cộng hoá trị?
A. Các hợp chất cộng hoá trị có nhiệt độ nóng chảy và nhiệt độ sôi thấp hơn các hợp chất ion.
B. Các hợp chất cộng hoá trị có thể ở thể rắn, lỏng hoặc khí trong điều kiện thường.
C. Các hợp chất cộng hoá trị đều dẫn điện tốt.
D. Các hợp chất cộng hoá trị không phân cực tan được trong dung môi không phân cực.
10.11
Đặt độ dài các liên kết N – N, N = N và N ≡ N lần lượt là lại I1; I2 và I3. Thứ tự tăng dần độ dài các liên kết là
A. I1; I2; I3.
B. I1; I3; I2.
C. I2; I1; I3.
D. I3; I2; I1.
10.12
Phát biểu nào sau đây đúng với độ bền của một liên kết?
A. Khi nhiều liên kết được hình thành giữa hai nguyên tử, độ bền của liên kết sẽ giảm.
B. Độ bền của liên kết tăng khi độ dài của liên kết tăng.
C. Độ bền của liên kết tăng khi độ dài của liên kết giảm.
D. Độ bền của liên kết không phụ thuộc vào độ dài liên kết.
10.13
Ammonia (NH3) khan (nguyên chất) được bơm vào đất ở dạng khí, là nguồn phân đạm phổ biến ở Bắc Mỹ do giá thành và tuổi thọ tương đối lâu trong đất so với các dạng phân đạm khác. Do tính ổn định của ammonia khan trên đất lạnh, nông dân trồng ngô thường bón ammonia khan vào mùa thu để bắt đầu hoạt động gieo trồng vào mùa xuân. Giải thích sự tạo thành liên kết trong phân tử ammonia.
10.14
Viết công thức electron, công thức Lewis và công thức cấu tạo của:
a) H2O.
b) NH3.
c) CO2.
10.15
Ozone (O3) là một loại khi có tính oxi hoá mạnh, phân tử gồm ba nguyên tử oxygen. Ozone xuất hiện ở tầng đối lưu và tầng binh lưu của khí quyển. Tuy thuộc vào vị trí của ozone trong các tầng trên mà nó ảnh hưởng đến sự sống trên Trái Đất theo các cách tốt, xấu khác nhau. Phân tử ozone có sự hiện diện liên kết cho – nhận. Viết công thức Lewis và công thức cấu tạo của ozone.
10.16
Ammonium (NH4+) là chất thải của quá trình trao đổi chất ở động vật. Với cá và động vật không xương sống dưới nước, ion ammonium được bài tiết trực tiếp vào nước. Ở động vật có vú, cá mập và động vật lưỡng cư, ion ammonium được chuyển đổi trong chu trình urea thành urea (NH2)2CO. Ở chim, bò sát và ốc trên cạn, ion ammonium được chuyển hoá thành uric acid. Ion ammonium là nguồn cung cấp nitrogen quan trọng cho nhiều loài thực vật. Trình bày liên kết cho - nhận trong ion ammonium.
10.17
Nhận xét điểm giống nhau và khác nhau giữa liên kết ion và liên kết cộng hóa trị. Cho ví dụ.
10.18
Hydrogen sulfide (H2S) là một chất khí không màu, mùi trứng thối, độc. Theo tài liệu của Cơ quan Quản lí an toàn và sức khỏe nghề nghiệp Hoa Kì, nồng độ H2S khoảng 100 ppm gây kích thích màng phổi. Nồng độ khoảng 400 – 700 ppm, H2S gây nguy hiểm đến tính mạng chỉ trong 30 phút. Nồng độ trên 800 ppm gây mất ý thức và nguy cơ làm tử vong ngay lập tức.
a) Viết công thức Lewis và công thức cấu tạo của H2S.
b) Em hiểu thế nào về nồng độ ppm của H2S trong không khí?
c) Một gian phòng trống (25°C; 1 bar) có kích thước 3 m x 4 m x 6m bị nhiễm 10 gam khí H2S. Tính nồng độ ppm của H2S trong gian phòng trên. Đánh giá mức độ độc hại của H2S trong trường hợp này. Cho biết 1 mol khi ở 25°C và 1 bar có thể tích 24,79 L.
10.19
Vẽ sơ đồ biểu diễn sự xen phủ giữa orbital 1s của nguyên tử hydrogen và orbital 3p của nguyên tử chlorine trong sự hình thành liên kết ở trong phân tử hydrogen chloride (HCl).
10.20
Nhận xét mối tương quan giữa độ dài liên kết và năng lượng liên kết dựa theo kết quả bảng sau
|
|
C-C |
C=C |
C≡C |
|
Độ dài liên kết (oA) |
1,54 |
1,34 |
1,20 |
|
Năng lượng liên kết (kJ/mol) |
347 |
614 |
839 |
10.21
Giải thích vì sao độ âm điện của nitrogen là 3,04 xấp xỉ với độ âm điện của chlorine là 3,16 nhưng ở điều kiện thường, nitrogen kém hoạt động hơn nhiều so với chlorine.
10.22
Dưới đây là biểu đồ tương tác của hai nguyên tử hydrogen ở thể khí so với khoảng cách hạt nhân giữa chúng:
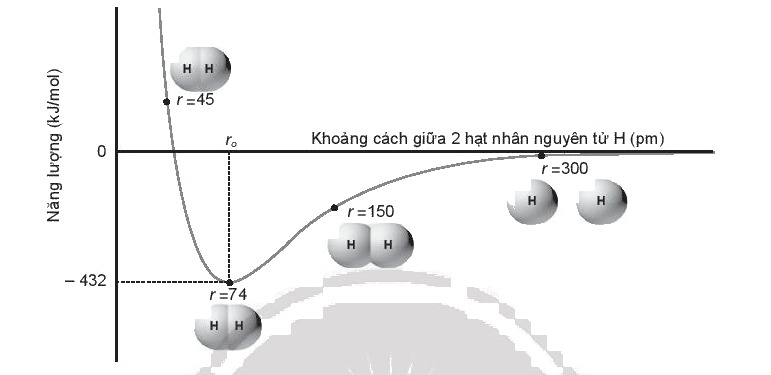
Cho biết năng lượng liên kết của phân tử hydrogen (H2) và độ dài liên kết H-H là bao nhiêu? Giải thích.
10.23
Sodium chloride tan được trong nước hay trong dầu hoả? Giải thích.
10.24
Vì sao benzene (C6H6) không tan trong nước nhưng tan tốt trong các dung môi hữu cơ như tetrachloromethane (CCl4), hexane (C6H14),...?
10.25
Biết phân tử BF3 có cấu trúc phẳng, phân tử CCl4, có cấu trúc hình tứ diện đều. Hãy cho biết có bao nhiêu phân tử phân cực và không phân cực trong hình dưới đây? Giải thích.
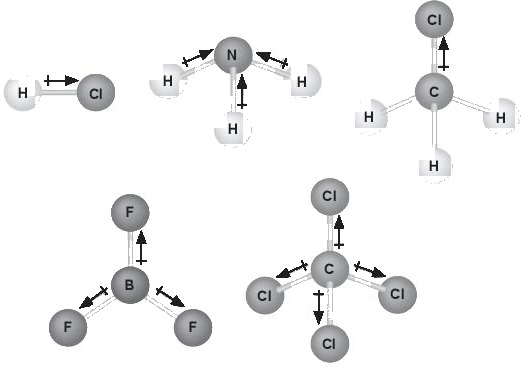
10.26
a) Ở 25°C và 0,99 atm, khả năng tan của carbon dioxide (CO2) trong nước là 1,45 gam/L, kém hơn nhiều so với sulfur dioxide (SO2) là 94 gam/L. Giải thích nguyên nhân sự khác biệt.
b) Nhận xét độ tan của carbon dioxide trong nước theo nhiệt độ dựa trên đồ thị sau.
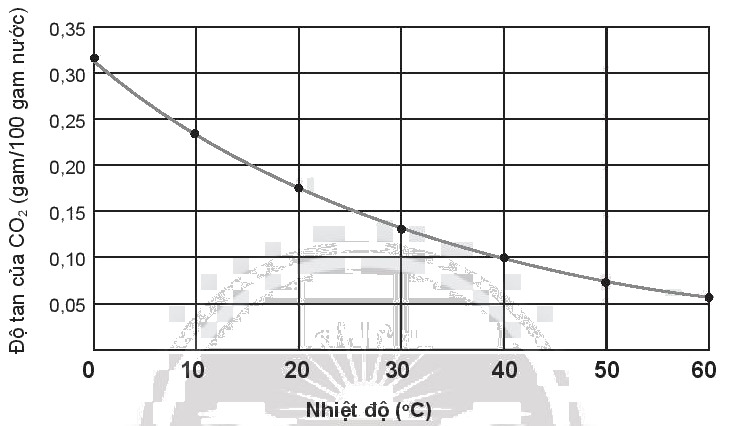
c) Nước giải khát có gas là gì? Vì sao người ta thường ướp lạnh các loại nước giải khát có gas trước khi sử dụng?
d) Vì sao trong những ngày hè nóng bức, cá thường phải ngoi lên mặt nước để thở, trong khi vào mùa lạnh, điều này không xảy ra?
Mẹo tìm đáp án nhanh
Search Google: "từ khóa + baitap365" Ví dụ: "Bài 5 trang 13 SGK Vật lí 12 baitap365