Đừng bỏ lỡ những tính năng hấp dẫn của Baitap365.com
Đề thi học kì 2 Hóa 10 - Chân trời sáng tạo
Đề thi học kì 2 Hóa 10 Chân trời sáng tạo - Đề 1
Đề thi học kì 2 Hóa 10 Chân trời sáng tạo - Đề 2 Đề thi học kì 2 Hóa 10 Chân trời sáng tạo - Đề 3 Đề thi học kì 2 Hóa 10 Chân trời sáng tạo - Đề 4 Đề thi học kì 2 Hóa 10 Chân trời sáng tạo - Đề 5 Đề thi học kì 2 Hóa 10 Chân trời sáng tạo - Đề số 6 Đề thi học kì 2 Hóa 10 Chân trời sáng tạo - Đề số 7 Đề thi học kì 2 Hóa 10 Chân trời sáng tạo - Đề số 8 Đề cương ôn tập học kì 2 Hóa 10 - Chân trời sáng tạoĐề thi học kì 2 Hóa 10 Chân trời sáng tạo - Đề 1
Trong phản ứng oxi hóa – khử, chất oxi hóa là chất:
Đề bài
Phần trắc nghiệm (7 điểm)
Câu 1: Trong phản ứng oxi hóa – khử, chất oxi hóa là chất
A. nhận electron.
B. nhường electron.
C. nhường electron.
D. nhận proton.
Câu 2. Trong phản ứng hóa học: Fe + H2SO4 →FeSO4 + H2, mỗi nguyên tử Fe đã
A. nhường 2 electron.
B. nhận 2 electron.
C. nhường 1 electron.
D. nhận 1 electron.
Câu 3. Số oxi hóa của S trong các hợp chất H2S, SO2 lần lượt là
A. -2, +4.
B. -4, +2.
C. -2, +6.
D.-2, -4.
Câu 4. Cho phản ứng sau: NH3 + O2 → NO + H2O. NH3 đóng vai trò là
A. chất oxi hóa.
B. chất khử.
C. chất tạo môi trường.
D.chất nhận electron.
Câu 5. Xét phản ứng: Fe+ HNO3 → Fe(NO3)3 + NO + H2O. Tổng hệ số cân bằng của phản ứng (tối giản) là
A. 9.
B. 10.
C. 11.
D. 12.
Câu 6. Phản ứng giải phóng năng lượng dưới dạng nhiệt gọi là
A. phản ứng thu nhiệt.
B. phản ứng tỏa nhiệt.
C. phản ứng oxi hóa – khử.
D. phản ứng phân hủy.
Câu 7. Cho phương trình nhiệt hóa học của phản ứng:
2H2(g) + O2(g) → 2H2O(l) ΔrH0298= -571,68 kJ
Phản ứng trên là phản ứng
A. thu nhiệt.
B. tỏa nhiệt.
C. không có sự thay đổi về năng lượng.
D. có sự hấp thụ nhiệt lượng từ môi trường xung quanh.
Câu 8. Cho phường trình nhiệt hóa học của phản ứng:
N2(g) + O2(g) → 2NO(g) ΔrH0298= +179,20 kJ
Phản ứng trên là phản ứng
A. thu nhiệt.
B. không có sự thay đổi năng lượng.
C. tỏa nhiệt.
D. có sự giải phóng nhiệt lượng ra môi trường.
Câu 9. Phát biểu nào sau đây là không đúng?
A. Biến thiên enthalpy càng âm, phản ứng tỏa ra cành nhiều nhiệt.
B. Biến thiên enthalpy càng dương, phản ứng thu vào càng nhiều nhiệt.
C. Với phản ứng tỏa nhiệt, năng lượng của hệ chất phản ứng cao hơn năng lượng của hệ sản phẩm.
D. Với phản ứng thu nhiệt, năng lượng của hệ chất phản ứng cao hơn năng lượng của hệ sản phẩm.
Câu 10. Dấu hiệu để nhận ra phản ứng là phản ứng oxi hóa – khử dựa trên sự thay đổi đại lượng nào sau đây của nguyên tử?
A. Số mol.
B. Số oxi hóa.
C. Số khối.
D. Số proton.
Câu 11. Để xác định được mức độ phản ứng nhanh hay chậm người ta sử dụng khái niệm nào sau đây?
A. Tốc độ phản ứng.
B. Phản ứng một chiều.
C. Cân bằng hóa học.
D. Phản ứng thuận nghịch.
Câu 12. Hoàn thành phát biểu về tốc độ phản ứng sau:
“Tốc độ phản ứng được xác định bởi độ biến thiên ..(1)… của (2) trong một đơn vị ..(3)…”
A. (1) nồng độ, (2) một chất phản ứng hoặc sản phẩm, (3) thể tích.
B. (1) thời gian, (2) một chất sản phẩm, (3) nồng độ.
C. (1) nồng độ, (2) một chất phản ứng hoặc sản phẩm, (3) thời gian.
D. (1) thời gian, (2) các chất phản ứng, (3) thể tích.
Câu 13. Các yếu tố ảnh hưởng đến tốc độ phản ứng là
A. nồng độ, nhiệt độ, chất xác tác, áp suất, diện tích bề mặt.
B. nồng độ, nhiệt độ, thời gian phản ứng, chất xúc tác.
C. nhiệt độ, thời gian phản ứng, chất xúc tác, diện tích bề mặt.
D. nồng độ, thời gian phản ứng, áp suất, chất xúc tác.
Câu 14. Khi cho cùng một lượng nhôm vào cốc đụng dung dịch axit HCl 0,1M, tốc độ của phản ứng lớn nhất khi dùng nhôm ở dạng nào sau đây?
A. Dạng viên nhỏ.
B. Dạng tấm mỏng.
C. Dạng bột mịn, khuấy đều.
D. Dạng nhôm dây.
Câu 15. Cho phương trình hóa học:
2KMnO4(aq) + 10 FeSO4(aq) + 8 H2SO4(aq) →5Fe2(SO4)3(aq) + K2SO4(aq) + 2MnSO4(aq) + 8H2O(l).
Với cùng một lượng các chất tham gia phản ứng, chất phản ứng nhanh nhất là
A. KMnO4.
B. FeSO4.
C. H2SO4.
D. Cả 3 chất hết cùng lúc.
Câu 16. Các nguyên tố halogen thuộc nhóm
A. IA.
B. IIA.
C. VIIA.
D. VIA
Câu 17. Cấu hình electron lớp ngoài cùng của nguyên tử các nguyên tố halogen là
A. ns2np4.
B. ns2np5.
C. ns2np3.
D. ns2np6.
Câu 18. Trong tự nhiên, halogen tồn tại ở dạng
A. đơn chất.
B. muối halogenua.
C. oxit.
D.cả đơn chất và hợp chất.
Câu 19. Đơn chất halogen tồn tại thể lỏng ở điều kiện thường là
A. F2.
B. Cl2.
C. Br2.
D. I2.
Câu 20. Liên kết trong các phân tử đơn chất halogen thuộc liên kết
A. cho – nhận.
B. ion.
C. cộng hóa trị phân cực.
D. cộng hóa trị không phân cực.
Câu 21. Ứng dụng nào sau đây không phải của Cl2?
A. Xử lý nước bể bơi.
B. Sát trùng vết thương trong y tế.
C. Sản xuất nhựa PVC.
D. Sản xuất bột tẩy trắng.
Câu 22. Halogen nào dùng trong sản xuất nhựa Teflon?
A. Chlorine.
B. Iodine.
C. Fluorine.
D.Bromine.
Câu 23. Đặc điểm của halogen là
A. nguyên tử chỉ nhận thêm 1 electron trong các phản ứng hóa học.
B. tạo liên kết cộng hóa trị với nguyên tử hydrogen.
C. nguyên tử có số oxi hóa -1 trong tất cả các hợp chất.
D. nguyên tử có 5 electron hóa trị.
Câu 24. Dung dịch AgNO3 không tác dụng với dung dịch
A. NaI.
B. NaF.
C. NaCl
D. NaBr.
Câu 25. Cho 15,8 gam KMnO4 tác dụng hết với dung dịch HCl đậm đặc. Giả sử hiệu suất phản ứng là 100% thì thể tích (đktc) khí Cl2 thu được là
A. 5,6 lít.
B. 0,56 lít.
C. 2,8 lít.
D. 0,28 lít.
Câu 26. Nguyên tố halogen dùng làm gia vị, cần thiết cho tuyến giáp và phòng ngừa khuyết tật trí tuệ là
A. chlorine.
B. iodine.
C. bromine.
D. fluorine.
Câu 27. Điều kiện nào sau đây không phải điều kiện chuẩn?
A. Áp suất 1 bar và nhiệt độ 25oC hay 298K.
B. Áp suất 1 bar và nhiệt độ 298K.
C. Áp suất 1 bar và nhiệt độ 25oC.
D. Áp suất 1 bar và nhiệt độ 25K.
Câu 28. Phát biểu nào sau đây là không đúng?
A. Dung dịch hydrofluoric acid có khả năng ăn mòn thủy tinh.
B. NaCl rắn tác dụng với H2SO4 đặc, nóng thu được hydrogen chloride.
C. Hydrogen chloride tan nhiều trong nước.
D. Lực acid trong dãy hydrohalic acid giảm dần từ HF đến HI.
Phần tự luận (3 điểm)
Câu 1. Lập phương trình hóa học của các phản ứng sau bằng phương pháp thăng bằng electron, nêu rõ chất oxi hóa, chất khử trong mỗi trường hợp.
a, HCl + MnO2 → MnCl2 + Cl2 + H2O.
b, Fe3O4 + HNO3 → Fe(NO3)3 + NO + H2O.
Câu 2. Cho phương trình nhiệt hóa học sau:
SO2(g) + 1/2 O2(g) → SO3(g) ΔrH0298= -98,5 kJ
a, Tính lượng nhiệt giải phóng ra khi chuyển 74,6 gam SO2 thành SO3.
b, Giá trị ΔrH0298của phản ứng: SO3(g) → SO2(g) + 1/2O2(g) là bao nhiêu?
Câu 3. Nghiền mịn 10 gam một mẫu đá vôi trong tự nhiên, hòa tan trong lượng dư dung dịch HCl thu được 4 gam khí carbonic. Tính hàm lượng calcium carbonate trong mẫu đá vôi.
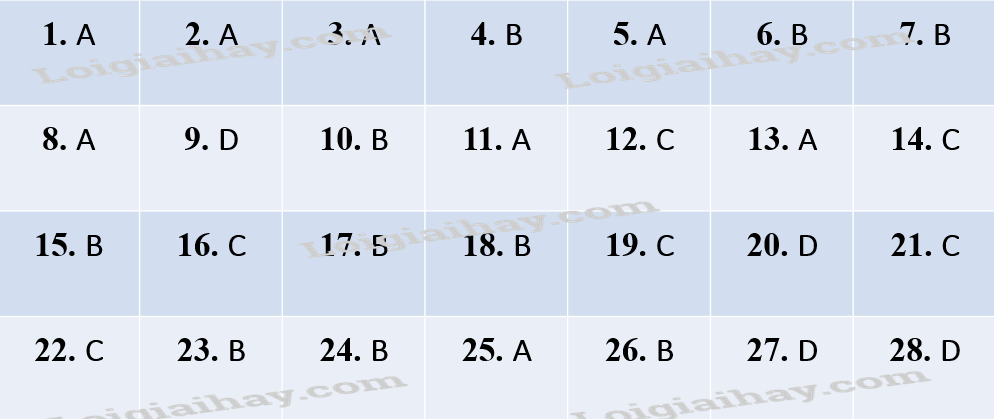
Đáp án
Phần trắc nghiệm (7 điểm)
Câu 1: Trong phản ứng oxi hóa – khử, chất oxi hóa là chất
A. nhận electron.
B. nhường electron.
C. nhường electron.
D. nhận proton.
Phương pháp giải:
Chất oxi hóa là chất nhận electron.
Chất khử là chất nhường electron.
Mẹo tìm đáp án nhanh
Search Google: "từ khóa + baitap365" Ví dụ: "Bài 5 trang 13 SGK Vật lí 12 baitap365