Đừng bỏ lỡ những tính năng hấp dẫn của Baitap365.com
Đề thi giữa kì 1 Hóa 10 - Chân trời sáng tạo
Đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo - Đề số 12
Đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo - Đề số 13 Đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo - Đề số 11 Đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo - Đề số 10 Đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo - Đề số 9 Đề thi giữa kì Hóa 10 Chân trời sáng tạo - Đề số 8 Đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo - Đề số 7 Đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo - Đề số 6 Đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo - Đề số 5 Đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo - Đề số 4 Đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo - Đề số 3 Đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo - Đề số 2 Đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo - Đề số 1Đề thi giữa kì 1 Hóa 10 Chân trời sáng tạo - Đề số 12
Các nguyên tố hóa học ở nhóm IIA trong bảng tuần hoàn thuộc khối các nguyên tố.
Các nguyên tố hóa học ở nhóm IIA trong bảng tuần hoàn thuộc khối các nguyên tố.
f
d
s
p
Đáp án : C
Dựa vào lớp và phân lớp.
Các nguyên tố nhóm IIA thuộc khối các nguyên tố s trong bảng tuần hoàn.
Đáp án C
Theo mô hình nguyên tử hiện đại
các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định, tạo thành đám mây electron.
orbital nguyên tử kà khu vực không gian xung quanh hạt nhân.
các electron chuyển động trên những quỹ đạo tròn hay bầu dục xung quanh hạt nhân.
các electron chuyển động rất nhanh cách xa hạt nhân.
Đáp án : A
Dựa vào mô hình nguyên tử của Ruther – Bohr.
Các electron chuyển động rất nhanh xung quanh hạt nhân không theo một quỹ đạo xác định, tạo thành đám mây electron.
Đáp án A
Nguyên tử nguyên tố X có tổng số hạt là 28; trong đó hạt mang điện ở hạt nhân ít hơn hạt
không mang điện là 1 hạt. Cho các phát biểu sau:
(a) Nguyên tử X có 5 electron ở lớp ngoài cùng.
(b) Nguyên tử X có 3 electron độc thân.
(c) Tổng số electron trên phân lớp s là 4.
(d) Nguyên tố X là phi kim
Số phát biểu đúng là
3
2
1
4
Đáp án : B
Dựa vào cấu hình electron X.
Ta có: P + N + E = 28
N – P = 1
→P = E = 9; N = 10.
Cấu hình electron của X là: 1s22s22p5
a. sai, nguyên tử X có 7 electron ở lớp ngoài cùng.
b. sai, nguyên tử X có 1 electron độc thân.
c. đúng
d. đúng
Đáp án B
Tổng số electron trong ion AB3−4là 50. Số hạt mang điện trong nguyên tử A nhiều hơn số hạt mang điện trong hạt nhân nguyên tử B là 22. Số proton của nguyên tử A, B lần lượt là
16 và 7
7 và 16
15 và 8
8 và 15.
Đáp án : C
Dựa vào thành phần nguyên tử.
Số hạt mang điện trong nguyên tử A nhiều hơn số hạt mang điện trong hạt nhân nguyên tử B là 22:
2PA – PB = 22
Tổng số electron trong ion AB3−4là: EA + 4.EB + 3 = 50
Và P = E
Giải hệ phương trình: {2PA−PB=22EA+4EB+3=50P=E→{PA=15PB=8
Đáp án C
Cấu hình electron nguyên tử của X là 1s22s22p63s23p3. Phát biểu nào sau đây sai?
Lớp L có 8 electron.
Lớp M có 5 electron.
Lớp K có 2 electron
Lớp ngoài cùng có 3 electron.
Đáp án : D
Dựa vào cấu hình electron nguyên tử của X.
Lớp K có 2 electron
Lớp L có 8 electron
Lớp M có 5 electron
Đáp án D
Nếu 5 electron được điền vào 3 AO thì số lượng electron độc thân là
0
1
2
5
Đáp án : B
Dựa vào orbital nguyên tử.
5 electron được điều vào 3AO thì số lượng electron độc thân là 1.
Đáp án B
Cho cấu hình electron nguyên tử của các nguyên tố sau:
X: 1s22s22p63s2 Z: 1s22s22p63s23p63d54s2
Y: 1s22s22p63s23p5 R: 1s22s22p6
Các nguyên tố kim loại là
X, Y, Z
X, Z
X, Z, R
X, Y, R.
Đáp án : B
Số electron hóa trị 1,2,3 thường là kim loại.
X, Z có 2 electron hóa trị nên là kim loại.
Đáp án B
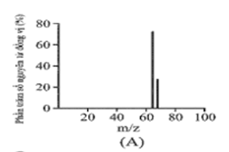
Đồng có hai đồng vị bền trong tự nhiên là và . Nguyên tử khối trung bình của đồng là 63,55 (điện tích Z của các ion đồng vị đồng đều bằng 1+). Hình vẽ phổ khối nào dưới đây là đúng?
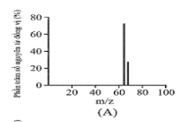
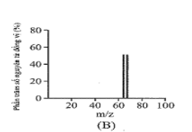
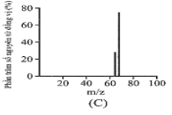
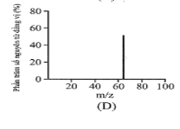
Đáp án : A
Dựa vào phổ khối.
Hai nguyên tố X và Y đứng kế tiếp nhau trong một chu kì có tổng số hạt mang điện trong hai hạt nhân là 25. Vị trí của X và Y trong bảng tuần hoàn là
chu kì 3 và các nhóm IA và IIA
chu kì 2 và các nhóm IA và IIA.
chu kì 3 và các nhóm IIIA và IVA
chu kì 3 và các nhóm IIA và IIIA.
Đáp án : D
Dựa vào cấu tạo bảng tuần hoàn.
Vì X và Y đứng kế tiếp nhau trong một chu kì nên: ZY – ZX = 1
Tổng số hạt mang điện trong hai hạt nhân là: PX + PY = 25
Giải hệ phương trình {PX+PY=25−PX+PY=1→{PX=12PY=13
X và Y thuộc chu kì 3 và các nhóm IIA và IIIA.
Đáp án D
Hòa tan 0,03 gam hỗn hợp hai kim loại X và Y thuộc hai chu kì liên tiếp của nhóm IA (MX < MY) vào H2O thì thu được 0,02479 lít khí H2 (đkc). X và Y lần lượt là
Li và Na
K và Rb
Na và K
Rb và Cs.
Đáp án : A
Dựa vào tính chất hóa học của nhóm IA.
Gọi R là nguyên tố tổng quát.
n H2 = 0,02479 : 24,79 = 0,001 mol
R + H2O →ROH + ½ H2
0,002 ← 0,001
ˉMR=0,030,002=15
MX < ˉMR< MY →X là Li, Y là Na
Đáp án A
Phát biểu nào sau đây sai?
Các nguyên tố nhóm VIIIA có 8 electron ở lớp ngoài cùng.
Các nguyên tố nhóm VIA có 6 electron ở lớp ngoài cùng.
Các nguyên tố nhóm IA có 1 electron ở lớp ngoài cùng
Các nguyên tố nhóm IIIA có 3 electron ở lớp ngoài cùng.
Đáp án : A
Dựa vào cấu tạo của bảng tuần hoàn.
A sai, vì He thuộc nhóm VIIIA nhưng có 2 electron lớp ngoài cùng.
Đáp án A
X được dùng làm chất bản dẫn trong kĩ thuật vô tuyến điện, chế tạo pin Mặt Trời. Nguyên tử của nguyên tố X có 3 lớp electron. Lớp ngoài cùng có 4 electron. Cấu hình electron của nguyên tử X là:
1s22s22p5.
1s22s22p6.
1s22s22p63s23p2.
1s22s22p63s1.
Đáp án : C
Dựa vào cấu hình electron của X.
Cấu hình của nguyên tử X là: 1s22s22p63s23p2.
Đáp án C
Trong tự nhiên chlorine có hai đồng vị bền: 3717Cl chiếm 24,23% tổng số nguyên tử, còn lại là 3517Cl. Thành phần % theo khối lượng của đồng vị 37Cl trong HClO4 là
8,43%
8,79%
8,92%
8,56%
Đáp án : C
Dựa vào công thức tính nguyên tử khối trung bình.
ˉACl=37.24,23%+35.(100−24,23)100=35,4846
%37Cl trong HClO4 là: 37.24,23%1+35,4846+16.4.100=8,92%
. Cho các phát biểu sau:
(1) Chỉ có nguyên tử magnesium mới có tỉ lệ số proton và neutron là 1:1
(2) Nguyên tử aluminum có 3 lớp electron.
(3) Nguyên tử khối là khối lượng tương đối của nguyên tử.
(4) Hai nguyên tử 23492Uvà 23592Ukhác nhau về số electron.
(5) Khối lượng nguyên tử tập trung phần lớn ở lớp vỏ nguyên tử.
Số phát biểu đúng là
2
3
4
1
Đáp án : A
Dựa vào thành phần nguyên tử.
(1) sai, calcium có tỉ lệ số proton và neutron là 1:1
(2) đúng
(3) đúng
(4) sai, hai nguyên tử 23492Uvà 23592Ucó cùng số electron.
(5) sai, khối lượng nguyên tử tập trung ở hạt nhân.
Đáp án A
Gali (Z=31) được Boisbaudran phát hiện năm 1875, ông gọi là nguyên tố “gallia” theo tên cổ xưa của nước Pháp, quê hương ông. Ga có 2 đồng vị với số neutron lần lượt là 38 và 40, có nguyên tử khối trung bình là 69,798. Phần trăm số nguyên tử của đồng vị Ga có số khối nhỏ là
39,9%
60,1%
59,4%
40,6%
Đáp án : B
Dựa vào công thức tính nguyên tử khối trung bình.
Gọi % đồng vị của 69Ga và 71Ga lần lượt là a và 100 – a.
ˉAGa=69.a+71.(100−a)100=69,798→a=60,1%
Đáp án B
Trong 5 nguyên tử 3517X,3416Y,168Z,8034T,178Rcặp nguyên tử nào là đồng vị của nhau?
X và R
Y và Z
Y và T
Z và R
Đáp án : D
Đồng vị là các nguyên tố có cùng số proton khác nhau số khối.
Z và R có cùng số proton khác nhau về số khối.
Đáp án D
Nguyên tố R có Z = 25, vị trí của R trong bảng tuần hoàn là
chu kì 4, nhóm VIIA
chu kì 4, nhóm VB
chu kì 4, nhóm IIA
chu kì 4, nhóm VIIB.
Đáp án : D
Dựa vào cấu tạo của bảng tuần hoàn.
Cấu hình electron R là: 1s22s22p63s23p63d54s2
R thuộc chu kì 4, nhóm VIIB.
Đáp án D
Electron thuộc lớp nào liên kết chặt chẽ với hạt nhân nhất?
Lớp N
Lớp L
Lớp M
Lớp K
Đáp án : D
Các lớp càng gần hạt nhân càng liên kết chặt chẽ.
Lớp K gần hạt nhân nhất nên liên kết chặt chẽ nhất.
Đáp án D
X và Y (ZX < ZY) là hai kim loại thuộc cùng nhóm A, ở hai chu kì liên tiếp. Biết ZX + ZY = 32.
Hiệu số hạt mang điện trong hạt nhân của Y và X là 8.
Tính kim loại của X mạnh hơn của Y.
X và Y đều có 2 electron ở lớp ngoài cùng
X có độ âm điện lớn hơn Y.
Hiệu số hạt mang điện trong hạt nhân của Y và X là 8.
Tính kim loại của X mạnh hơn của Y.
X và Y đều có 2 electron ở lớp ngoài cùng
X có độ âm điện lớn hơn Y.
Xác định ZX; ZY.
Ta có: {ZY−ZX=1ZX+ZY=32(L) hoặc {ZY−ZX=8ZX+ZY=32→{ZY=20ZX=12(TM)
a. đúng
b. sai, tính kim loại của Y mạnh hơn X.
c. đúng
d. đúng
Cho 3 nguyên tố: 168X,166Y,189Z,199T
X và Y là 2 đồng vị của nhau
X với Y có cùng số khối.
Có ba nguyên tố hóa học
Z và T thuộc cùng nguyên tố hóa học.
X và Y là 2 đồng vị của nhau
X với Y có cùng số khối.
Có ba nguyên tố hóa học
Z và T thuộc cùng nguyên tố hóa học.
Dựa vào nguyên tố hóa học.
a. Sai, vì X và Y không thuộc cùng nguyên tố hóa học.
b. đúng
c. đúng, X, Y, Z là nguyên tố hóa học
d. đúng
Cho kí hiệu nguyên tố: 5224X
Nguyên tử X có tổng các hạt mang điện nhiều hơn số hạt không mang điện là 20.
Nguyên tử X có 4 lớp electron.
Cấu hình electron của nguyên tử X là [Ar]3d44s2
X là kim loại.
Nguyên tử X có tổng các hạt mang điện nhiều hơn số hạt không mang điện là 20.
Nguyên tử X có 4 lớp electron.
Cấu hình electron của nguyên tử X là [Ar]3d44s2
X là kim loại.
Dựa vào kí hiệu nguyên tố hóa học.
a. đúng, tổng số hạt mang điện của X là 48, hạt không mang điện là 28.
b. đúng
c. sai, cấu hình electron của X là [Ar]3d54s1
d. đúng
Chọn phát biểu đúng, sai
Các nguyên tử có 2 electron lớp ngoài cùng đều là nguyên tử của nguyên tố kim loại.
Trong nguyên tử, các electron nằm trên cùng một lớp có mức năng lượng gần bằng nhau.
Trong các nguyên tử, lớp K là lớp có mức năng lượng cao nhất và liên kết bền chặt nhất với hạt nhân.
Tất cả các nguyên tử của nguyên tố khí hiếm đều có cấu hình electron lớp ngoài cùng là ns2np6.
Các nguyên tử có 2 electron lớp ngoài cùng đều là nguyên tử của nguyên tố kim loại.
Trong nguyên tử, các electron nằm trên cùng một lớp có mức năng lượng gần bằng nhau.
Trong các nguyên tử, lớp K là lớp có mức năng lượng cao nhất và liên kết bền chặt nhất với hạt nhân.
Tất cả các nguyên tử của nguyên tố khí hiếm đều có cấu hình electron lớp ngoài cùng là ns2np6.
Dựa vào lớp và phân lớp.
a. sai, vì He có 2 electron lớp ngoài cùng nhưng thuộc khí hiếm.
b. đúng
c. sai, lớp K có mức năng lượng thấp nhất.
d. sai, He có cấu hình 1s22s2
Nguyên tố magnesium (Mg) có trong loại bột màu trắng có tên gọi là “magnesium
carbonate” (MgCO3) mà người ta vẫn hay gọi là “ bột magnesium”. MgCO3 là loại bột rắn mịn, nhẹ có tác dụng hút ẩm rất tốt. Khi tiến hành thi đấu, bàn tay của các vận động viên thường có nhiều mồ hôi, làm giảm độ ma sát khiến các vận động viên không nắm chắc được các dụng cụ khi thi đấu. Điều này không chỉ ảnh hưởng xấu đến thành tích mà còn gây nguy hiểm khi trình diễn. MgCO3 có tác dụng hấp thụ mồ hôi đồng thời tăng cường độ ma sát giữa bàn tay và các dụng cụ thể thao giúp vận động viên có thể nắm chắc dụng cụ và thực hiện các động tác chuẩn xác hơn. Bằng Phương pháp phân tích khối phổ cho thấy trong tự nhiên Mg có ba đồng vị bền: 24Mg; 25Mg và 26Mg. Tính khối lượng MgCO3 chứa 5,418.1022 nguyên tử 25Mg? (cho C=12, O=16, số Avogadro = 6,02.1023)
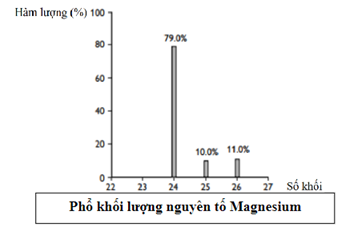
Dựa vào công thức tính nguyên tử khối trung bình.
ˉAMg=24.79+25.10+26.11100=24,32
Số mol của 25Mg = 5,418.10226,02.1023=0,09mol
Số mol của MgCO3 = 0,09:10% = 0,9 mol
Khối lượng MgCO3 = 0,9.84,32 = 75,888 ≈76
Bằng Phương pháp phân tích phổ khối cho thấy trong tự nhiên chlorine có hai đồng vị bền: 35Cl và 37Cl. Hãy tính khối lượng NaCl trong 100ml dung dịch chứa NaCl 0,2M. Biết nguyên tử khối Na là 23 (giá trị được tính làm tròn 2 con số sau dấu phẩy)
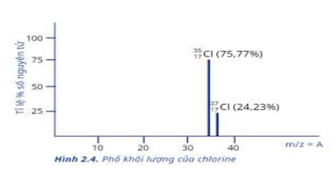
ˉACl=35.75,77+37.24,23100=35,4846
n NaCl = 0,1.0,2 = 0,02 mol
m NaCl = 0,02.(58 + 35,4846) = 1,88g
Đáp án 1,88
Oxide của kim loại M có dạng M2O được ứng dụng trong nhiều ngành công nghiệp như sản xuất xi măng, sản xuất phân bón, … Oxide này (M2O) là chất rắn, màu trắng, tan nhiều trong nước và là thành phần dinh dưỡng không thể thiếu đối với mọi loại cây trồng. Xác định công thức phân tử của M2O biết tổng số hạt cơ bản trong phân tử M2O là 140, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 44; nguyên tử oxygen trong M2O có 8 neutron, và 8 electron.
Theo dữ kiện đề bài ta có:
2(2ZM + NM) + 2ZO + NO =140 => 4ZM + 2NM + 2.8 + 8 = 140 (1)
=>4ZM + 2.8 – (2NM + 8) = 44 (2)
Giải hệ (1) và (2) => ZM = 19 (K), NM = 20.
Công thức M2O: K2O
Nếu coi hồng cầu có hình dạng đĩa tròn với đường kính 7,8 µm thì cần bao nhiêu nguyên tử Helium (có đường kính là 0,62Å) sắp xếp thẳng hàng và khít nhau để tạo nên đoạn thẳng có chiều dài bằng đường kính của hồng cầu?
dđĩa =7,8 µm; dHe = 0,62 Å = 0,62.10-4 µm
=>Số nguyên tử He) sắp xếp thẳng hàng và khít nhau = 7,80,62.10−4≈ 125806 nguyên tử.
Mẹo tìm đáp án nhanh
Search Google: "từ khóa + baitap365" Ví dụ: "Bài 5 trang 13 SGK Vật lí 12 baitap365